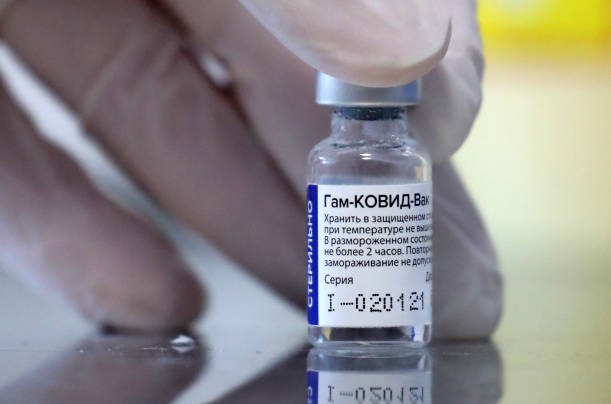
Vakcína Sputnik V, ktorou ako jediní v Európskej únii (EÚ) očkujú len Maďari, aktuálne stále čaká na registráciu Európskou liekovou agentúrou (EMA). Práve chýbajúce odsúhlasenie zo strany EMA spôsobilo kľúčový rozkol v koalícii, ktorá stojí pred rozpadom.
Premiér Igor Matovič (OĽaNO) s už bývalým ministrom zdravotníctva Marekom Krajčím (OĽaNO) chceli vakcínu vyvinutú Gamalejovým národným výskumným centrom začať používať aj bez schválenia ako neregistrovaný liek. Ostatní koaliční partneri však boli proti.
Väčšina sa do jesene proti covidu zrejme nezaočkuje. Je to fatálne, ani ľudia nad 60 rokov nechcú vakcínu, hovorí analytik
Napriek tomu, že vláda nákup ruskej vakcíny neodsúhlasila, premiér ju napokon kúpil a 1. marca doviezol na Slovensko, čím oficiálne započal koaličnú krízu. Priznal to v nedeľu na sociálnej sieti. Samotná vakcína je pritom podľa odborného časopisu Lancet vysoko kvalitná.
V čom je teda pri jej registrácii a používaní problém?
Postup testov
Vakcínu Sputnik V, vzhľadom na snahu o jej použitie aj bez registrácie EMA, začali okamžite po dovoze skúmať v spoločnosti Imuna Pharm v Šarišských Michaľanoch, a to na myšiach a morčatách.
Skúška trvala sedem dní. Celé pozorovacie obdobie sa neprejavili žiadne prejavy toxicity, nestratili na hmotnosti, žiadne zviera neuhynulo. Čiže dopadla s vyhovujúcim výsledkom.
Viac o téme: Koronavírus
„Keď sa vyrobí šarža lieku, tak výrobca musí na konci urobiť výstupnú kontrolu. Ruský výrobca kontroluje asi 15 parametrov, okrem iného aj skúšku abnormálnej toxicity na morčiatkach. Táto skúška sa nachádza v ruskom liekopise, takže pre nich je to lege artis postup,“ vysvetlila Zuzana Baťová, riaditeľka Štátneho ústavu pre kontrolu liečiv (ŠÚKL).
Ruská vakcína je veľká neznáma. Rezort odpovede na praktické otázky nemá, očkovať by sa pritom mohlo už v marci
Lege artis je v medicíne postup zdravotníckeho pracovníka, ktorý je v súlade so súčasnými poznatkami vedy. Zjednodušene to v tomto prípade znamená, že výrobca v procese postupuje podľa aktuálnych poznatkov a zaužívaných postupov.
Dokumenty v azbuke
Táto skúška sa kedysi nachádzala aj v európskom liekopise, odtiaľ však v roku 2018 „vypadla“. ŠÚKL ale v rámci kontroly dovezenej šarže vakcíny Sputnik V musí urobiť všetko to, čo výrobca, inak samotná kontrola podľa Baťovej nemá zmysel.
A práve z tohto dôvodu sa proces zdržal. „Už máme dokumentáciu a informácie k tomu, ktoré výstupné parametre je potrebné skontrolovať na danej šarži,“ informovala na parlamentom zdravotníckom výbore Baťová o tom, čo im ku kontrole chýbalo.
Dodala, že posledných 20 rokov funguje ŠÚKL v rámci česko-slovenských alebo európskych pravidiel, preto na začiatku nevedeli, ako kontrolu vykonať tak, aby bola v súlade s ruskými štandardmi a pravidlami.
„Ruský liekopis je iný, ruské požiadavky na správnu výrobnú prax sú iné. My ich nepoznáme, sú v azbuke a je veľmi, veľmi náročné urobiť ten prekryv s európskymi. Toto bude v Európe problém,“ doplnila šéfka ŠÚKL s tým, že to nehodnotí ako dobré ani zlé.
Pätina z toho, čo treba
Aj pre Rusov je to podľa nej v poriadku, sú na podobné postupy a rozdiely vo vyhodnocovaní zvyknutí. Podobný problém sa v iných štátoch mimo Európy, ktoré vakcíny proti ochoreniu COVID-19 vyrábajú, rieši takisto.
Rusko sa dohodlo s Indiou, v krajine vyrobia stovky miliónov dávok Sputnika
Americké, kanadské a japonské procesy výroby a kontroly sú na „viac ako 90 percent“ rovnaké, ako európske štandardy. To znamená, že ak čínsky alebo indický výrobca požiada hociktorú z týchto krajín o audit správnej výrobnej praxe, certifikát je platný aj v ostatných.
Preto je rozhodnutie o registrácii EMA také dôležité. Samostatne je ŠÚKL pre ministerstvo zdravotníctva schopní urobiť iba výstupnú kontrolu dovezenej šarže, čo je „iba jedna malinká časť“ celkovej dokumentácie k registrácii vakcíny.
Európska lieková agentúra odobrila štvrtú vakcínu proti COVID-19, Janssen je prvá jednodávková
„To, čo nám bolo dodané, k tomu sme rozhodne schopní dodať stanovisko. Momentálne je to však asi iba 20 percent z toho, čo je potrebné na celú registráciu,“ definovala Baťová s tým, že ide vlastne len o pätinu z toho, čo bežne robí EMA pri registrácii novej vakcíny.
Chýbajúci Modul 3
Ďalšou kľúčovou otázkou je, kedy sa EMA k registrácii Sputnika V vyjadrí. Zdá sa však, že tak skoro to nebude. Podľa Baťovej stále chýba časť dokumentov od výrobcu, ktorej sa hovorí Modul 3. V žiadnej dostupnej databáze nie je k dispozícii ani zoznam nežiaducich účinkov.
Zaujímavé je aj to, že žiadna krajina, v ktorej sa Sputnikom V očkuje, nežiaduce účinky takisto nezverejnila, a to napriek tomu, že štáty si robia vlastnú dokumentáciu k hláseným vedľajším účinkom. Baťová vysvetlila, že ich musia oficiálne hlásiť cez výrobcu vakcíny.
Maďarsko schválilo ďalšie dve vakcíny, ktoré sú z krajín mimo Európskej únie
Rusi sa však o tieto údaje zatiaľ s nikým nepodelili, ani po opätovnom vyžiadaní. „Chýba nám veľa údajov, a to nám v ŠÚKL, ako aj Európskej liekovej agentúre. Dožiadavame ich, stále ich od ruského výrobcu žiadame,“ tvrdí Baťová.
Vakcína Sputnik V je podľa doterajších informácií zazmluvnená v 26 krajinách sveta. Avšak počet štátov, v ktorých sa ňou aj masovo očkuje, je omnoho menší, čo potvrdila aj Baťová.